1. 서 론
2. 방법론
2.1 대기 및 수중 아산화질소 발생량 측정
2.2 수리조건 및 토양특성
2.3 랜덤포레스트 모델링
3. 결과 및 고찰
3.1 아산화질소 배출에 대한 토양 용존 유기탄소의영향과 미세지형적 차이
3.2 N2O 발생량에 영향을 미치는 조절인자
4. 결 론
1. 서 론
아산화질소(N2O)는 강력한 온난화 기체로서 50~100년 시간규모에서 이산화탄소에 비해 온난화능이 대략 300배가 높은 영향력을 가지고 있어(Forster et al., 2007) 기후변화에 주요한 역할을 하지만, 발생원으로부터 발생하는 기체의 양을 정량화 하거나 발생 요인과 조건을 특정하는데 불확실성이 존재한다(Groffman et al., 2000; Sutton et al., 2007). 아산화질소(N2O) 발생에 하천과 강은 주요한 발생원으로 기후 변화 예측에 매우 중요하지만 그 영향력과 발생량 추정에 대한 연구에도 큰 불확실성이 있다. Hu et al. (2016)에 따르면 강이나 하천으로부터 발생하는 N2O 양은 과거 보고에 따르면 300-2100 Gg N2O-N/yr이지만 발생량에 영향을 미칠 수 있는 인자들과 함께 메타 모델을 구성한 결과에 따르면 약 29.6-35.3 Gg N2O-N/yr로 큰 차이를 보인다. 이런 불확실성은 하천과 강 수계에서의 질소 순환의 복잡성, 수리학적 특성과 생지화학적 과정의 각각 특성이 미치는 영향력의 분리나 상호작용 이해의 어려움, 그리고 최근 하천과 강에 가해지는 인류의 활동에 의한 영향력 증가를 들 수 있다(Kuypers et al., 2018; Stein and Klotz, 2016). 강과 하천의 N2O 발생량과 그 중요성은, 기후변화 유발 기체의 거동을 이해하거나 기후변화를 예측하는데 큰 중요성을 가지지만, 자체의 복잡성, 상호작용, 변동성으로 인해 강과 하천의 N2O 발생의 메커니즘이나 관련 조절인자를 규명하는 것에는 어려움이 있어, N2O 발생량 예측은 큰 불확실성을 가진다.
강이나 하천의 특성은 지하수나 토양, 대기로부터 유입되는 물질과 환경 내부에서의 물리적 저장과 생지화학적 이동, 전환, 제거과정을 걸쳐 결정되는 결과적인 균형에 의해서 강과 하천의 수질과 환경적 특성이 결정된다(Burgin and Hamilton, 2007; Dahm et al., 1998; Mulholland et al., 2008; Seitzinger et al., 2006). 최근 들어 수생태계에 대한 인류활동에 영향이 증가하였는데, 하천 주변부 토지이용도 변화, 농업이나 실물성장을 위해 사용하는 질소비료 사용량이 증가하면서 비점오염원으로부터, 질소화합물이 수생태계로 쉽게 유입되어 질소 순환에 변화를 야기하여, 과도하게 투입되는 질소화합물질은 수생태계에 큰 변화를 야기했다(Jin et al., 2018; Jurado et al., 2017; Li et al., 2019; Sanchez et al., 2017). 그 영향으로는 부영양화나 환경의 무산소화, 저산소화, 물고기 폐사, 독성 조류의 과대 증식 등 수생태계의 기능이 줄어들 거나(Kemp and Dodds, 2002), 하천으로 유입되는 질소산화물과 유기물이 증가함에 따라서, 미생물의 탈질 활동이 대기로 질소를 방출하는, 전 지구적인 질소 순환에 기여하는 역할이 증가했다(Baulch et al., 2011; Hasegawa et al., 2000; Liu and Greaver, 2009; Mosier and Kroeze, 2000). 증가한 하천 탈질 과정은 유입된 질소 오염원으로부터 수질을 정화시키고 생태계를 유지하는 동시에, 온난화가체인 N2O의 잠재적 발생량에 큰 영향을 미쳤다.
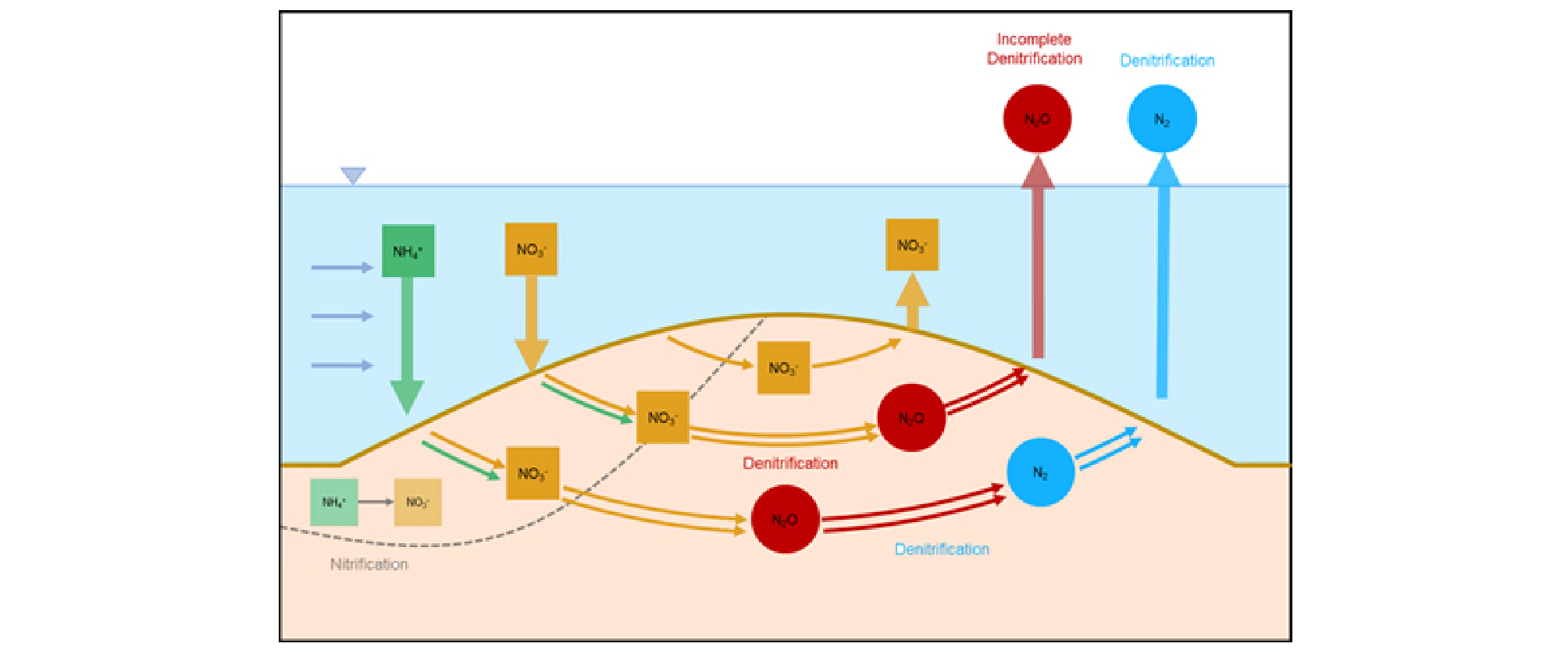
N2O를 생산하는 주요한 과정은 크게 3가지로 분류된다. 첫번째는 질산염(NO3-)이나 아질산염(NO2-)의 이원자 질소기체(N2)로의 환원 과정, 두번째는 암모니아(NH3)의 NO3-이나 NO2-로의 산화 과정, 세번째로 NO3-의 NH3로의 이화적 환원과정이다. 강과 하천의 하상 내부나 혼합대(hyporheic zone)와 같은 혐기적 조건 하에서는 첫번째 과정인 혐기적 탈질과정이 N2O 발생의 대부분을 차지하며 낮은 산소 농도 하에서는 두번째 과정인 질산화의 부가 산물로서 N2O가 배출되거나 질산균 탈질화(nitrifier denitrification) 과정에서 N2O가 발생한다(Wrage et al., 2001; Zhu et al., 2013). 혐기적 탈질은 NO3-을 NO2-, 산화질소(NO), N2O를 통해 N2를 생성하는 연속되는 다단계(multi-step) 생물학적 반응이며 N2O가 중간생성체로 배출되며 질산균 탈질화 과정은 암모니아(NH3)를 하이드록실아민(NH2OH), NO2- , NO, N2O를 통해 N2로 연속적으로 산화, 환원이 일어나는 다단계 과정이다. 혐기적 탈질 과정과 질산균 탈질화 과정(이후, ‘탈질’로 통합해 언급)의 다단계 과정에서 중간 산물로 발생하는 N2O는 여러 조건들에 의해서 발생량이 변화하며 환경의 화학적 조건에 따라서 반응 자체가 증가한다(Quick et al., 2019).
탈질 반응은 주로 혐기성조건이나 낮은 산소조건 하에서 질산염이나 아질산염과 같은 반응성을 보이는 질소와 에너지원이 되는 유기탄소가 존재할 때, 탈질 미생물의 활동에 의해 발생하기 한다(Gaimster et al., 2018; García-Ruiz et al., 1999). 하천 내의 질소의 순환은 수체 내에서 일어나지만, 강과 하천의 수체는 빠른 유속과 높은 유동성에 의해 미생물이 반응 하기위한 조건이 형성되기 어렵기 때문에 하상 내부나 혼합대에서 대부분 질소 순환 반응이 발생한다. 혼합대는 미생물들이 붙어서 생장할 수 있으며, 계속적으로 용질이 유입되고 반응이 충분히 일어날 수 있을 만큼 물과 퇴적물의 접촉 기간이 길기 때문에 화학적, 생물학적 반응이 활발히 일어날 수 있는 곳이다(Cardenas et al., 2004; Marzadri et al., 2014). 또한 혼합대 표면에는 미생물 양과 활성도가 높으며 유기물이 축적되기 좋은 환경이 조성되어 반응성이 높고 공간적으로 불균일한 환경이 조성된다(Arango et al., 2007; Harvey et al., 2013). 하상 구조에 따라 변화하는 혼합대 내부의 유체 흐름은 퇴적물에서 활동하는 탈질 미생물의 활동성에 영향을 미칠 수 있으며 지형학적 특성과 기질이용성, 환경조건이 연계되어 탈질의 반응조건과 N2O 발생량이 변화하는 미세지형(micro- topography)이 형성된다.
하상 내부에서 반응은 혼합대 내부 흐름을 통해 일어나며, 반응물과 생성물은 물의 흐름을 따라 이동하며 수중으로 배출될 때까지 반응이 일어난다. 탈질 과정을 통해 생성되는 N2O와 같은 용존 기체는 혼합대 내부 흐름을 따라 이동하다 하천 수중으로 이동, 대기로 방출되는 과정을 수반한다(Bardini et al., 2012; Boano et al., 2010). 따라서 탈질 과정 중 대기로 배출되는 N2O 발생량은 탈질 과정을 통해서 토양이나 퇴적물에서 생성되는 N2O 뿐만 아니라, 생성된 N2O가 대기로 방출되기 전에 N2로 전환되어 대기로 방출되는, N2O 소비량으로 인한 균형을 통해 정해진다. 미세지형 차이와 혼합대 내부 흐름에 따라서 탈질 반응 정도가 달라지며 배출되는 산물이나 양이 변화한다. 다단계의 탈질 반응은 혼합대 내부를 흐르는 물의 흐름 길이에 따라 반응시간이 달라지기 때문에 불완전한 탈질을 할 가능성이 있다. 불완전한 탈질은 질소 산화물이 다단계의 탈질 과정에서 N2까지 완전 탈질되지 못하고 이전단계에서 혼합대 흐름길이에 따라 수중으로 배출되는 것이다. 따라서 내부 흐름의 정체 시간이나 반응시간에 따라서, 탈질 반응 초기에서 중단되어 NO3- 형태로 배출되거나 중간 수준에서 중단되어 NO2 형태로 배출되거나 반응시간이 더 증가하면 N2로 완전 탈질이 일어날 수 있다. 따라서 하천의 N2O 발생량은 지형 내부의 흐름이 N2O를 생성하는 수준의 정체시간을 가졌을 때 높아진다. 또한 반응성이 높은 질소 농도나 유기탄소의 농도와 같은 환경요인과 기질이용성, 지형구조, 수리학적 특성이 연계되어 형성되는 미세지형에 따라 온난화기체인 N2O 발생량이 변화할 수 있다.
N2O 발생량을 예측하는 것은 전지구적 질소순환을 이해하는데 큰 도움이 된다. 하지만 질소순환, N2O 발생은 미생물의 활동에 의해서 작동하는 다단계 생물학적 과정이며 각 과정은 환경인자와 지형학적, 수리학적 특징에 영향을 받기 때문에 각 요인에 따른 N2O 발생량 변화에 대한 이해는 아직 모호하다. 각과정은 에너지원, 전자 수용체, 기타 영양물질들의 이용가능성과 온도, 수심, 유속과 같은 환경인자 뿐만 아니라 혼합대 흐름과 기질 유입, 배출을 지배하는 혼합대의 지질, 지형학적 특성 등의 물리적 구조들의 상호작용을 통해 달라진다. 따라서 미세지형적 차이를 바탕으로 탈질과정에서 N2O의 발생량의 차이를 분석하는 것은 질소순환에 탈질 과정을 통하여 발생하는 온난화기체를 예측하는데 중요한 과제이다.
미세지형의 생지화학적 특성과 하상 퇴적물의 물리적 구조나 화학적 특성 등 미세지형 특성을 분석하고 하상에서 N2O 발생량과 연계하면 주요한 작동인자를 살펴볼 수 있으며, 이에 따라 하천 생태계의 어떤 특성이 주요하게 N2O 발생량에 영향을 미치는지 이해할 수 있다. 탈질과정은 기질인 유기물과 질소 산화물이 일차적으로 큰 영향을 줄 것으로 판단하여, 본 실험의 가설은 하상 지형에 의해 달라지는 하상 내부 흐름과 지형 위치에 따라서 탈질 정도가 변화하고 그로 인해 N2O 발생량이 영향을 받으며, 이렇게 N2O 발생량에 영향을 주는 미세지형적 차이는 유기 탄소의 농도에 의해 조절된다는 것이다. 따라서 본 실험은 인공 수로를 형성, 수로 내에 사구 지형을 만들고 지형 내 위치에 따라 N2O 발생량을 측정한다. 그에 따라 지형적 변화가 가지는 물리적, 화학적 특징을 분석하고 미지형의 변화에 따라 달라지는 N2O 발생량 변화와 N2O 발생량에 미치는 탄소 가용성의 효과를 분석한다.
2. 방법론
본 실험은 지형학적 특성이 N2O 기체발생에 미치는 영향을 모사하기 위하여 수로 내부에 사구를 형성한 인공의 2차원 하천수로를 제작하였다. 실험 장소는 경상북도 안동시에 한국건설기술연구원(Korea Institute of Civil Engineering and Building Technology, KICT) 안동하천실험센터(River Experiment Center, REC) 실험 수로에서 진행하였다. 실험 수로는 순환 수로로 설계되어 길이 37 m, 높이 1.2 m, 폭 1 m을 가지며 배출되는 유출수가 순환하여 유입수로 다시 수로 내부로 들어오는 구조이다. 수로 중앙 10 m 구간에 사질토의 하상을 포설하였다. 질소 순환의 영향을 보기 위해서 실험 시작 5일 전에 요소비료(㈜풍농, 46% N) 0.5 kg N/m2를 투입하여 5~10 cm 깊이로 사질토 토양과 균일하게 섞었다. 이런 상태에서 사질토 하상 중앙에는 길이 1.0 m, 높이 0.15 m의 사구를 만들었다.
실험은 2018년 6월 19일부터 22일까지 1차 실험(E1)을 진행했고, 9월 13일부터 9월 18일까지 2차 실험(E2)을 진행하였다. 두가지 독립된 실험은 동일한 수로, 수리학적, 지형학적 구조를 가지지만 퇴적물의 다른 유기탄소 농도(DOC)를 가진다. 평균적인 DOC는 E1, E2 각 실험에서 32.61 ± 8.45 mg C/kg dry soil, 17.18 ± 3.76 mg C/kg dry soil (mean ± s.d.) 로 차이를 보인다. 실험의 수리학적 조건은 5.81 ± 0.84 m/s의 유속과 평균 수심 36.11 ± 0.03 cm으로 동일하게 유지하였다. 사구주변에 기체포집을 위한 챔버를 사구 구조의 하상 내부 흐름을 고려하여, 물의 흐름 방향으로 5개(E1) 또는 7개(E2)를 설치하였다. 샘플링 위치는 물의 흐름 방향으로 순서에 따라 A, B, C, D, E이며, A는 물의 흐름의 앞부분, E는 마지막 지점으로 C지점은 사구의 최고점에, B와 D는 사구 경사 지점이다. 추가적으로 E2 실험은 사구 지형에 영향을 받지 않는 평평한 하상 지형을 가지는 X, Y 지점을 추가적으로 설치하여 하상구조에 의한 N2O 발생량 변화 영향을 비교했다. 모든 기체측정은 삼반복으로 진행했으며, 사구 주변 기체 수집으로 N2O 배출량을 측정하였다.
2.1 대기 및 수중 아산화질소 발생량 측정
자연하천의 하상형태 중 하나인 사구 형태 구조로 인한 미세구조 변화로 유발되는 혼합대 흐름 변화가 수문학적, 수리학적, 생지화학적으로 N2O 배출에 미치는 영향을 파악하기 위해 설계된 인공수로의 사구에 공기 유입이 없는 PVC 챔버(지름 5.5 cm, 높이 45 cm)를 사구 주변에 설치했으며, 사구를 기준으로 상류방향과 하류방향의 평탄한 지형, 사구 경사로, 사구 마루에 표면으로부터 5~8 cm 깊이에 약 25 cm 간격으로 설치하였다. 실험 진행간 하상 사구 구조가 변화하지 않기 위한 수리 구조로 사구 구조 변화를 측정하여 챔버 설치로 인한, 유속에 의한 흐름과 하상 교란이 발생하지 않는 것을 확인해 실험을 진행하였다. 하천 하상에서 발생하는 N2O 흐름(퇴적물->물->대기)을 모사하기 위해 설계된 인공수로의 퇴적물층에 설치된 static chamber는 직접적으로 대기 중으로 배출되는 N2O를 측정할 수 있게 한다.
N2O 포집은 E1 5일, E2 7일간 하루에 2회 진행했으며 static chamber에 축적되는 기체를 10 ml 주사기로 12 ml 유리 바이알(vial)에 옮겨 보관했다. 20분의 시간 간격(0분, 20분, 40분)마다 챔버에 모이는 기체를 포집, 이후 실험실에서 N2O의 농도를 측정하여 하상에서 발생하는 N2O 발생량을 산정하였다. 20분 마다 얻어진 vial의 가스 샘플의 N2O 농도는 실험실로 옮겨진 후, flame ionization detector (FID), Electron capture detector (ECD)를 가진 GC (gas chromatograph)로 측정하였다. 시간에 따른 농도의 변화를 통해서 Flux를 계산하며 3개의 데이터 포인트(0-60분)를 1차 회기 방정식에 따라 얻어진다. Flux 계산은 다음을 따른다.
토양에서 발생한 N2O가 온도에 따라, 수로 내의 물 안에 녹는 용존 N2O의 농도가 변함에 따라, 이를 보정하기 위해서 N2O 용존 농도를 측정한다. 이를 위해 150 ml 유리 바이알(vial)에 실험 수로의 물을 보관해 실험실에서 용존 N2O 농도를 GC Headspace Equilibration Technique (RSKSOP-175)를 통해 도출했다(Hudson, 2006). 물에 녹은 기체는 헨리의 법칙(Henry’s Law)를 따름으로 밀봉된 물 샘플 150 ml에 Headspace를 부가적으로 만들어 준 후, Headspace의 N2O 농도를 측정해 헨리의 법칙에 따라 수중 N2O 농도를 계산한다.
2.2 수리조건 및 토양특성
사구주변에서 배출되는 N2O 배출량을 측정하기 위해 길이 1 m, 높이 0.15 m의 사구를 만들고 82시간 동안 0.018 m3/s의 유량을 공급하였다. 월류 수심은 상류단 위어에서 측정되어 유량을 산정하였고 접근 유속은 5.795 m/s로 측정되었으며, 사구에서 상류방향으로 약 2 m 떨어진 위치에서 1차원 미소유속계(KENEK VO1000RSM)를 이용하여 유속을 측정하였다(Ahn et al., 2019).
실험 수행되는 기간 동안 수로 내에서 순환되고 있는 수질 및 토양 분석을 같이 진행하였다. 현장 실측용 수질분석장비(HANNA, HI9828, Ver. 2.1)로 수온, pH, 용존산소(Dissolved Oxygen, DO) 등을 기체 측정과 밀접한 시간에 측정하였다. 현장 측정이 어려운 물의 암모늄(Ammonium), 질산염(Nitrate), 농도 및 총 질소(Total Nitrogen, TN)의 분석을 위해 멸균 채수병에 시료를 2L 채수하여 분석이 진행될 때까지 4°C에서 냉장 보관하였다.
N2O 발생량과 미세지형 특성을 분석하기 위해 분류된 5가지 위치의 토양 환경인자들의 특성을 반영하는 토양 용존 유기탄소(Dissolved organic carbon, DOC), 암모늄(Ammonium), 질산염(Nitrate), 아질산염(Nitrite) 농도를 측정하였다. 토양의 함수량과 유기물 함량(Organic matter, %)은 퇴적물을 105°C와 600°C, 각각에서 건조하는 방법인 the loss-on- ignition method를 사용하여 도출한다. 토양의 DOC는 퇴적물 3 g에 30 ml 3차 증류수를 주입한 후 centrifuge(2500 rpm, 5분)를 한 상등액을 0.45μm 필터에 걸러낸 시료를 TOC (Total organic carbon) analyzer (TOC-V, Shimadzu)를 통해 측정했다. 수로내 수중 DOC는 멸균한 120 ml 유리 바이알로 3반복 샘플링한 물을 0.45μm 필터 한 후 퇴적물의 DOC 측정과 동일한 장비로 측정한다. 샘플링한 토양과 수로의 물의 질산염 농도와 아질산염 농도는 DOC를 측정과 동일한 상등액을 0.22μm 필터 한 후 Ion chromatography (Thermo Fisher, IC-1100) 이용해서 측정했다.
2.3 랜덤포레스트 모델링
지형학적 차이와 미세지형의 환경인자들, 수리학적 특성과 N2O 발생량의 관계를 예측하기 위하여 랜덤포레스트(RandomForest, RF) 모델링을 사용하였다. 랜덤포레스트 모델은 반응변수(N2O Flux)를 모델링하는 매우 유연한 회기 기술로 복잡한 환경인자와 수리특성의 관계를 보여줄수 있다. 랜덤 포레스트 모델링은 다수의 설명변수를 가지는 환경인자들을 가지고 단일의 종속변수를 설명하는, 다수의 환경인자를 N2O 발생량과 연관 짓는데 일반적인 회기 방정식보다 적합한 회기 기술이다. 설명변수간에 상관 정도가 존재 할 수 있는 경우인, 환경인자, 수리학적, 지형학적 특성 데이터는 관계 분석시 부정적인 영향을 미치는 다중공산성에 직면할 수 있는 상황에서 다른 회기식 보다 과적합에 위험이 적고 자동적으로 적합도 측정과 모델에서 각 설명변수의 중요도를 계산할 수 있다.
RF 모델에서 환경인자, 수리학적 , 지형학적 특성을 대표하는 각각의 설명변수들의 역할은 부분종속성 그래프(partial dependence plot)과 변수 중요도(variable importance)로 나타난다. 변수 중요도는 각 변수가 모델의 정확도에 미치는 영향 정도를 제공한다. 각 변수의 예측치가 랜덤하게 제외되거나 교체되었을 때 모델의 성능 변화 정도에 따라서, 각 변수의 교체가 모델 성능을 크게 변화시키면 변수의 중요도가 높아진다. 부분 종속성 그래프는 각 설명변수의 연속적인 변화에 따라서 반응변수의 변화를 나타내주는, 각 종속변수의 독립변수에 대한 기여도를 변수에 대한 함수형태로 나타낸다. 이때 특정 변수의 변화에 대한 반응변수의 변화는 다른 변수는 모두 평균값으로 상정하고 이루어진다.
본 실험은 12개의 독립변수(환경인자; 기온, 토양 용존 유기탄소, 암모늄, 질산염, 아질산염, 수중 용존산소, 총 인, 용존 유기탄소, 전기전도도, 수리학적 특성; 유속, 지형학적 특성; 사구 지형에 따른 챔버위치)를 고려해서 독립변수인 N2O 발생량을 예측하고 각 변수의 반응성을 계산한다. 모든 통계 분석은 R 3.6.0에서 수행되며 RF 모델은 ‘RandomForest’ package를 이용한다.
3. 결과 및 고찰
3.1 아산화질소 배출에 대한 토양 용존 유기탄소의영향과 미세지형적 차이
상이한 토양 용존 유기탄소 농도(32.61 ± 8.45 mg C/kg dry soil, 17.18 ± 3.76 mg C/kg dry soil)을 가지는 두번의 인공 순환수로 실험(E1, E2)는 사구의 지형을 따라 측정한 N2O 발생량이 다른 경향을 나타낸다. 두 실험이 각각 평균적으로 사구를 통해 발생하는 N2O는 첫번째 실험에서 8.14 ± 9.84 μg N2O-N/m2 hr, 두번째 실험에서 0.356 ± 6.14 μg N2O-N/m2 hr이다. 두 실험은 하상의 물리 구조인 사구 모양이는 동일하고 수리학적 특성(유속, 유량)이 유사하지만, N2O 발생량은 약 23배 정도의 큰 차이를 보인다. 두 실험 간의 가장 큰 차이는 실험 초기의 토양 DOC 농도 차이로, 실험간 측정한 토양 DOC 농도는 E1, E2 실험 각각 33.0 ± 5.35 mg C/kg dry soil, 17.2 ± 1.79 mg C/kg dry soil로 약 2배 정도 차이를 나타낸다. 탈질 과정은 유기물이나 유기탄소, 탈질 미생물이 이용가능한 용존 유기탄소 농도나 탄소 이용성에 의해서 큰 폭으로 된다(Arango et al., 2007; Lan et al., 2017; Teixeira et al., 2010). DOC는 탈질 미생물이 쉽게 사용할 수 있는 에너지원으로 탈질 과정을 작동시키는 중요한 조절인자이다. 탈질은 전자수용체로 질소산화물을 이용하여 전자공여체인 유기탄소를 분해하는 과정으로 용존 유기탄소의 농도와 이용성은 탈질과정 자체의 정도를 크게 조절할 수 있다. 두 실험간 나타난 DOC 차이로 인해 증가한 탈질 반응성의 증가로 인해 전체적인 N2O 발생량이 크게 변했다.
탈질 정도나 N2O 발생량에 영향을 미치는 하상 지형학적 특징은 하상 지형의 구조에 따라 변화하는 내부 흐름에 의해 조절된다. 하상 구조에 따라 변화하는 하상 내부 유체의 흐름길이와 정체시간에 의해 내부 기질의 유입의 정도와 탈질 미생물과의 반응시간이 조절되며, 연속적인 다단계의 반응인 탈질 반응이 일어나는 수준이 결정된다(Fig 1.). 사구 형태의 하상구조에 물이 유입될 때 유입 위치에 따라서 배출되는 물 흐름의 길이가 결정되는데, 이 흐름길이에 따라서 유입되는 NH4+나 NO3-와 같은 반응의 기질이 상부의 짧은 흐름에서는 NO3-로 단순 배출되거나, 흐름길이가 길어질수록 연속적인 탈질 반응이 증가하면서 N2O 발생량이 증가하고 최종적으로 흐름길이가 완전탈질을 일으킬 정도로 길어지면 N2로 질소 산화물이 모두 변화한다.
탈질율 차이를 유발하는 조절인자인 토양 DOC가 높은 수로 실험에서는 지형적 차이에 의해, 사구를 따라 설치한 챔버 위치에 따라 N2O 발생량이 차이가 나타난다(A=7.01 ± 8.74μg N2O-N/m2 hr, B=6.59 ± 8.34μg N2O-N/m2 hr, C=8.05 ± 13.7μg N2O-N/m2 hr, D=14.6 ± 8.40μg N2O-N/m2 hr, E=3.64 ± 4.26μg N2O-N/m2 hr)(Fig. 2). 사구의 마루인 C 지점을 기준으로 앞쪽 경사(A, B) 지점은 질산화가 잘 일어나며, 혼합대 내부 흐름이 배출보다는 유입, 이송이 활발하게 일어날 수 있는 지형으로, 정체시간이 짧은 지점으로 N2O가 발생하기에 반응시간이 충분하지 않다. 반대로 뒤쪽 경사(D, E)에서 D 지점은 N2O를 배출하기에 충분한 흐름길이나 정체시간을 가지고 있어 불완전한 탈질이 발생해 N2O 발생량이 높은 지점으로, 혼합대 내부 흐름으로 유입되는 질산염이 탈질 과정 중 N2로 완전 탈질이 되기에는 충분하지 않은 반응 시간을 가져 가장 높은 N2O 발생량(D=14.6 ± 8.40μg N2O-N/m2 hr)을 보인다. E 지점에서 감소한 N2O 발생량은 완전 탈질로 인해서 오히려 N2O가 감소했다고 판단할 수 있다(Quick et al., 2019). 첫 번째 실험은 A~E 위치를 따라 흐르는 물의 흐름 길이를 따라 변하는 기질이용성 변화에 따라서 N2O 발생량이 변했다. NO3- > NO2- > NO> N2O> N2의 연속적인 탈질 진행과정에서 A, B 위치는 하상 내부를 흐르는 흐름이 짧기 때문에 N2O 발생량이 적었고 하상 내부의 흐름이 점점 길어지는 C, D에서 N2O 발생량이 증가하다, D지점에서 가장 높은 발생량을 보이며(14.6 ± 8.40μg N2O-N/m2 hr), 하상 내부 흐름이 가장 긴 E에서는 다시 N2O 발생량이 줄어드는 것은 하상 내부의 흐름이 길어 짐에 따라, 탈질의 연속적인 반응이 완전하게 일어난 것이라고 추론할 수 있다. Quick et al. (2016)에 따르면, 사구 지형의 흐름 방향에서 앞쪽 경사는 산소 농도가 뒤쪽 경사보다 높게 나타나며, 유입이 활발하게 일어나는 앞쪽 경사의 위치의 토양에 비해 흐름 유출이 발생하는 뒤쪽 경사 토양 공극수 내 N2O 농도가 높게 나타났다. 이는 지형학적 특성에 따라서 변화하는 혼합대 내부 흐름길이가 증가할수록 반응시간 길이가 늘어나 탈질 반응 정도가 증가하는 것이며 본 실험과도 유사하다. 따라서 하상 구조가 변화하면 지형학적 특성에 따른 효과에 의해 N2O 발생량과 탈질 반응정도가 변화한다.
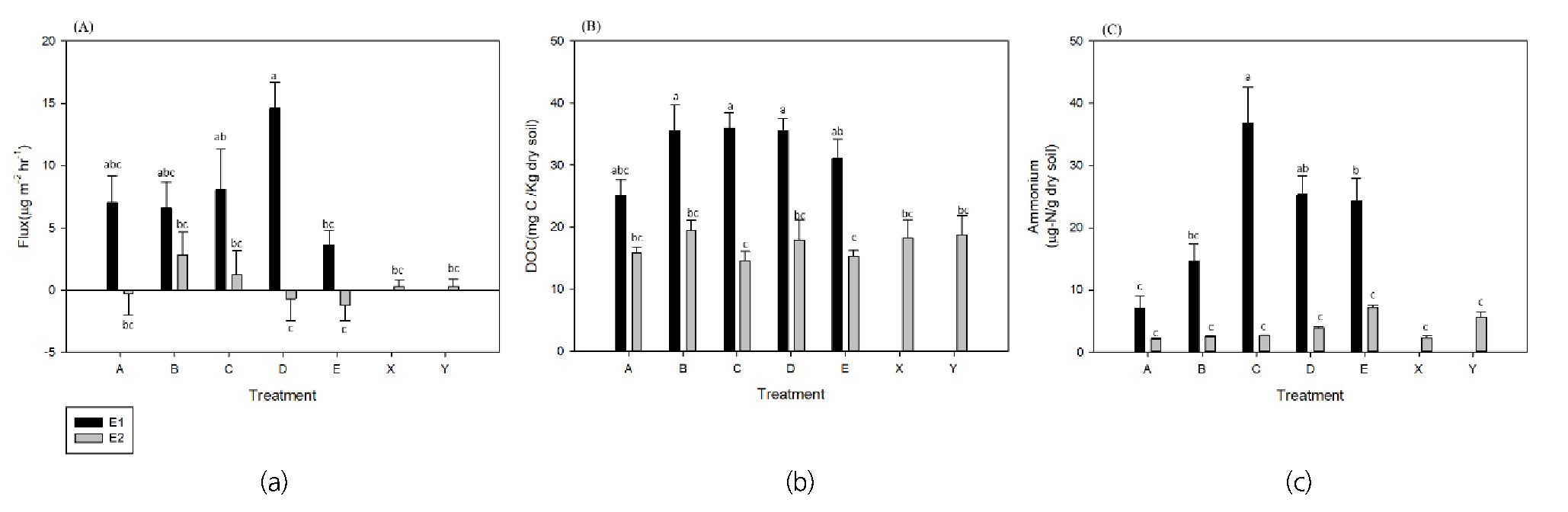
Fig. 2.
Nitrous oxide flux and Dissolved organic carbon (DOC) concentration from two-dimensional stream channel sediment soil. (A) Nitrous oxide flux, (B) DOC concentration, (C) Ammonium ion concentration, A-E is mentioned in materials and methods. X and Y point only were measured only E2 experiment and represented gas flux in flat sediment bed. Bar heights and error bars represent means and standard deviation. The lower-case letters a-c denote significant differences between sites (P < 0.001, analysis of variance with Tukey’s significant difference test, error bars denote mean standard error)
마루 형태의 단일 사구 내부의 흐름 길이는 A~E 순으로 짧을 것으로 추정할 수 있으며 본 실험의 결과를 통해서 나타난 사구에 따른 대기 중으로 방출되는 N2O 발생량 변화는 이처럼 위치에 따른 물의 정체시간과 기질의 반응시간에 따라 변화한다(Fig. 1). 본 실험은 하상 지형 변화에 따라 변화하는 탈질 산물 배출의 차이가 실제로 대기 중으로 방출되는 정도를 추정했으며, 하상 내부를 흐르는 흐름에 따라 변화하는 위치적 차이가 실제로 대기중 N2O 배출에 미칠 수 있는 영향을 파악했다. 대기 중으로 방출되는 N2O 또한 지형적 차이에 의해서 변화하며 결과에 따르면 평평한 지형을 가정한 상태에서 대기중으로 배출되는 N2O 발생량보다 사구 형태의 지형에서 대기중으로 배출되는 N2O 발생량이 10~30% 정도 높다.
토양 DOC 농도가 낮은 E2 실험에서는 위와 같은 유의미한 차이를 보이지 않으며(A=-0.265 ± 7.25μg N2O-N/m2 hr, B=2.84 ± 7.59μg N2O-N/m2 hr, C=1.29 ± 7.98μg N2O-N/m2 hr, D=-0.695 ± 7.43μg N2O-N/m2 hr, E=-1.23 ± 5.28μg N2O-N/m2 hr), 또한 E2 실험에서만 진행한 평평한 하상의 N2O 발생량(X=0.298 ± 2.14μg N2O-N/m2 hr, Y=0.301 ± 2.44μg N2O-N/m2 hr)과도 큰 차이를 보이지 않는다. 위의 결과는 토양 DOC가 탈질 반응을 통한 N2O 발생량에 강한 양의 상관관계를 보이고 있을 뿐만 아니라 지형 구조에 대한 차이를 유도하는 요인이 될 수 있음을 보여준다.
실험 설계간, 진행간 DOC의 차이를 보이는 E1과 E2 실험은 전반적인 생지화학적, 물리적 특성 차이를 나타낸다. NO2- 와 NO3- 농도는 각각 E1에서 1.21 ± 0.0467μg-N/g dry soil, 2.43 ± 0.432μg-N/g dry soil, E2에서 1.63 ± 0.170μg-N/g dry soil, 2.713 ± 0254μg-N/g dry soil (Fig. 3)로 E2에서 통계적으로 유의미한 차이를 보이며 높은 질산염과 아질산염 농도를 나타낸다. 이는 E1 실험에서 약 7배 정도의 상당히 높은 암모늄 농도를 보았을 때(Figs. 2 and 3), 실험 초기 사용한 요소 비료로 생성된 암모늄이 질산화 과정을 통해서 질산염과 아질산염이 생성되는 정도가 E2에서 높게 나타났기 때문이다. 따라서, 높은 질소산화물 농도에도 N2O 발생량 줄어든 것은 유기탄소 농도가 작아 탈질 과정이 억제됨에 따라 질산화의 산물인 질소산화물이 토양에 축적된 것이라고 여겨진다.
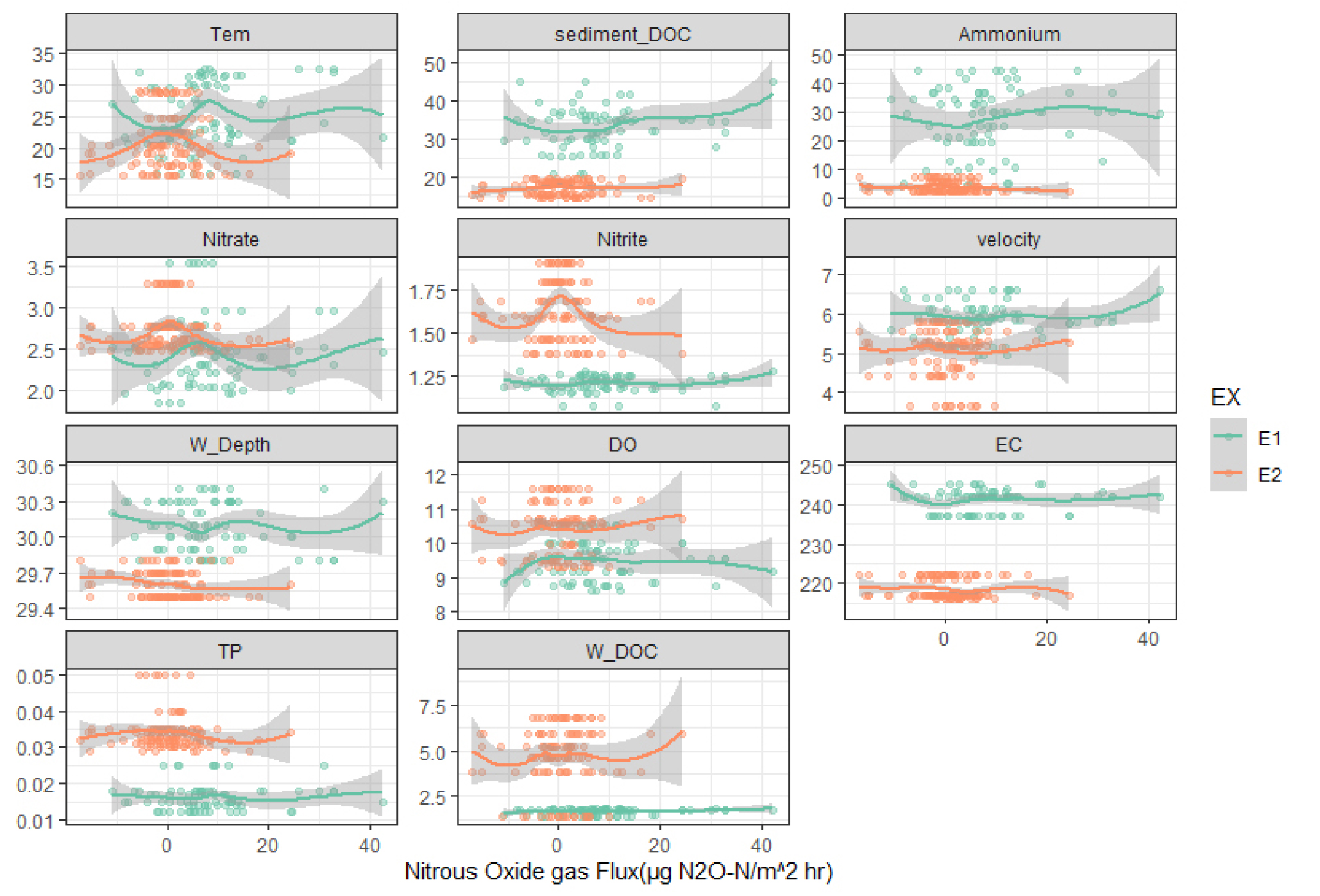
Fig. 3.
Relationship between Chemical and physical property of experiment 1 and 2 with Nitrous oxide flux. Tem; temperature (˚C), sediment_DOC; channel sediment dissolved organic carbon (mg/Kg dry soil) Ammonium; ammonium concentration in sediment (μg-N/g dry soil), Nitrate; Nitrite concentration in sediment (μg-N/g dry soil) Nitrate; nitrate concentration in sediment (μg-N/g dry soil) velocity; water velocity (cm/s), W_Depth; water depth, DO; dissolved oxygen, EC; electrical conductivity, TP; total phosphorous (mg/L), W_DOC; Dissolved organic matter concentration in water (mg/L). Smooth line show patterns in the presence of overplotting. Shading shows the 95% confidence intervals
하상 내부 흐름 길이 차이에 의한 위치 별 차이는 암모늄 이온에서도 나타났다. E1 실험의 위치에 따른 암모늄 농도는 A=14.4 ± 8.98μg-N/g dry soil, B=27.1 ± 12.1μg-N/g dry soil, C=37.7 ± 5.93μg-N/g dry soil, D=31.0 ± 6.24μg-N/g dry soil, E=26.1 ± 9.79μg-N/g dry soil로 하상 내부 흐름이 길어 N2O 발생량이 많은 C 지점에서 최고 값을 보이며 양방향으로 낮아지는 경향을 나타낸다. 유기물 차이로 인해 촉발된 탈질 반응과 미생물 활성으로 인해 단순히 탈질 반응 길이에 따라서 N2O 발생량이 변화하는 것뿐만 아니라 암모늄 이온의 농도도 비슷한 추세를 보이며, 지점에 서로 다른 기질 농도와 접근성을 가지는 미세지형을 형성하는 것으로 추정된다(Fig. 2). 지형적 차이에 따라서 혼합대 내부로의 용질의 유입이나 미생물의 생장정도, 미생물과 기질의 접촉시간, 반응시간에 따라서, 기질의 이동과 유입정도가 달라지며(Cardenas et al., 2004; Marzadri et al., 2014), 혼합대 내부의 기질 농도와 이용가능성이 공간적으로 불균등하게 나타난다(Arango et al., 2007; Harvey et al., 2013). 혼합대 내부 흐름 시작 지점인 A와B 유입지점은 용존 산소 농도가 높고 질산화가 활발히 일어나서(Quick et al., 2016) 암모늄의 농도가 낮아지는 지형적 농도 차이를 나타낸다.
지형 구조에 따른 흐름변화로 인한 N2O 발생량의 변화가 유기탄소가 충분한 존재하는 상황을 보이는 실험에서만 나타났으며 암모늄 농도 또한 위치에 따라 유사한 변화를 나타내는 것으로, 미세지형 차이는 유기탄소의 농도에 따라 촉발되는 것을 확인할 수 있다. 유기탄소 농도가 낮은 E2 실험과 비교했을 때, N2O 발생량이나 화학적 특성 차이는 단순히 물리적인 구조 차이에 의해서만 나타나는 것이 아니며, 영향을 받을 수 있는 환경의 특성에 따라 상호작용하며 달라진다. 본 실험에서 확인할 수 있는 탈질 정도나 N2O 발생량 차이는 유기탄소가 존재하는, 탈질이 충분히 일어날 수 있는 환경에서만 미세지형의 차이가 나타난다.
3.2 N2O 발생량에 영향을 미치는 조절인자
N2O 발생량과 환경 변수들 간의 관계는 RF 모델을 통해 평가하였다. RF 모델은 복잡한 관계를 보이는 환경 변수들을 고려하여, 예측하고자 하는 종속변수인 N2O 발생의 반응을 예측할 수 있는 유연한 회기 방법이다. 설명변수(온도, 유기탄소, 암모늄, 질산염, 아질산염, 유속, 수심, 용존 산소, 전기 전도도, 총인)와 N2O 발생양과의 복잡한 관계를 RF 모델에 근거하면 23.3% (Table 1) 설명할 수 있다. N2O 발생량과 높은 상관관계를 보이는 인자는 토양 유기탄소, 아질산염, 총인, 암모늄, 수심, 챔버 위치, 질산염, 온도, 전기 전도도, 유속, 실험 번호(E1 또는 E2), 수중 용존 유기탄소, 용존 산소 순이며, 이순서가 RF 모델을 통해 N2O 발생량을 예측하는데 중요한 인자들이다. 이 중 토양 유기탄소, 아질산염, 총인, 암모늄, 수심, 질산염, 온도가 N2O 발생량과의 관계에서 lnc. MSE (%)가 의미 있는 관계를 나타낸다(P < 0.05).
Table 1. The variable is used as predictors of N2O flux. Inc. MSE corresponds to the increase in the mean squared error of the RF model predictions after permutation excluding corresponding predictors. Inc. node purity is the average decrease in node impurity calculated as the residual sum of squared. Both factors mean assessment about the importance of model predictors. The higher the value of both factors is the more important variable
RF 모델 결과에서 토양 유기탄소는 하상 N2O 발생을 예측하는데 가장 중요한 요소이다. 토양 유기 탄소는 탈질 미생물의 에너지원으로, 탈질 작용 자체에 직접적으로 관여하는 인자로서, 탈질 반응 정도와 N2O 발생량 정도를 조절한다는 가설과 일치한다(Arango et al., 2007; Lan et al., 2017; Teixeira et al., 2010). 탈질 반응은 연적적인 다단계 생물 반응으로 절대적인 반응 정도가 증가함에 따라, 토양 유기탄소로 농도 상승으로 인해서 직접적으로 탈질 반응성이 상승하고 탈질 반응의 중간산물인 N2O 발생이 증가한다. 모델 결과에서 유기탄소의 농도가 증가할수록 N2O 발생량이 증가하는 양의 상관관계를 나타낸다. 낮은 수준의 유기탄소 농도에서부터, 농도 증가에 따라 N2O 발생량은 계단식으로 증가하는 경향을 보이며, 대략 30~40 mg C/kg dry soil의 유기물에서 N2O 증가가 감소한다(Fig. 4). 탈질 과정 중 대기로 배출되는 N2O 발생량은 혼합대 내부에서 탈질 과정을 통해서 생성되는 N2O 뿐만 아니라, 완전 탈질을 통해서 혼합대 내부에 생성된 N2O가 대기로 방출되기 전에 N2로 전환되어 대기로 방출되는, 생산과 제거 반응의 균형을 통해서 N2O 발생량이 정해진다. 즉, 유기탄소의 농도가 일정 수준보다 높은 지점에서는 탈질의 전 과정이 우호적으로 일어날 수 있어 N2O가 N2로 완전 탈질 되어 N2O 발생량이 감소한다(Lan et al., 2017). 이런 과정은 RF 모델 결과에서 나타나며 N2O 발생량의 증가와 감소에 기준이 될 수 있는 화학량적인 DOC 농도를 나타내며 N2O 발생량을 조절할 수 있는 DOC의 이용가능성과의 관계를 제시한다.
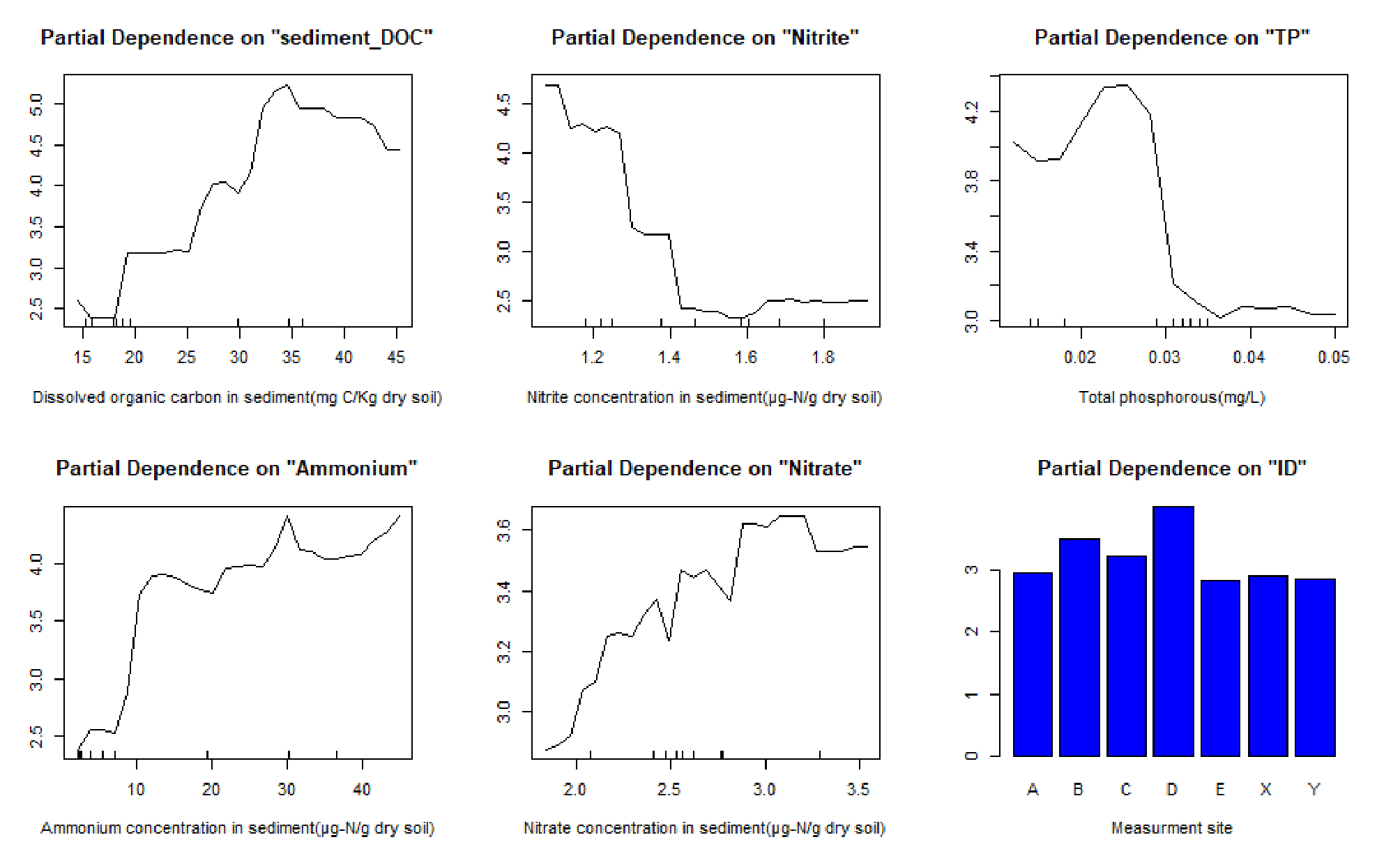
Fig. 4.
Partial dependence of the two-dimension flume sediment Nitrous oxide flux. In order of importance, significant variable is shown from top left to bottom right. (P < 0.05) Partial dependence plot represents a graphical depiction of the marginal effect of a variable on response of sediment N2O flux as regression function of predictors. Specific effect of variable is measured, when other variables are held at their mean
N2O 발생량은 NO3-, NO2-, NH4+와 같은 반응성이 높은 질소화합물과도 유의미한 상관관계를 보인다. 탈질 과정에 직접적으로 전자수용체와 같은 역할로 사용되는 질소산화물들과 N2O 발생량과의 관계에서 N2O 발생량은 NO2- 증가에 따라 감소하다 일정 수준(1.4 ~ 1.5 μg-N/g dry soil)에서 일정해지며, NO3- 증가에 따라 전구간 증가하는 경향을 보인다. 탈질 반응에 직접적으로 이용되는 질소 산화물 NO2-, NO3- 농도의 증가에 따라 N2O 발생량이 많아지지만(Dong et al., 2018; Wang et al., 2017b; Wang et al., 2017a), 본 실험에 경우에는 NO2-와 음의 상관관계를 보인다. 이런 경향은 실험 E1, E2의 절대적인 NO2- 농도 차이에 기인한 것으로 보이는데, E1 실험에 비해 E2 실험의 NO2- 농도가 전구간에서 약 2배정도 차이를 보이기 때문인 것으로 확인된다. NO2-은 NO3-에 비해 불안정하며, 질산화를 통해 생성되는 NO2-는 산소 농도가 낮은 상황에서 전자 수용체로 이용되어 질산균 탈질화를 진행하거나 암모니아 산화균에 의해서 NO3-으로 쉽게 산화되며(Shen et al., 2003), NO2-는 생물 독성을 가져 미생물들은 에너지반응이 아니더라도 이를 제거하는 기작을 가지고 있어 특정 환경이 아니면 축적되기 어렵다(Paul, 2007). 따라서 NO2- 농도가 더 낮은 E1 실험에서 N2O 발생량이 더 높았으며, NO2- 농도가 더 높은 E2 실험은 질산화 이후 과정이 유기탄소의 부족에 의해서 결여되었기 때문에 결과적인 관계에서 음의 관계를 가졌지만, 복합적으로 NO2-의 특성을 본다면 정량적인 관계에 대해서는 연구가 더 필요하다.
이와 반대로 NO3-은 NO2- 보다는 안정적이며 E1과 E2의 차이가 적고 지형 내 위치 간의 차이가 크며 N2O 발생량과의 관계도 이전 실험들과 일치한다(Dong et al., 2018; Wang et al., 2017b; Wang et al., 2017a). Körner and Zumft (1989)는 질소산화물이 탈질 효소 생산이 미치는 영향을 P. stutzeri 순수 배양을 통해 연구했고 NO3-가 유의미하게 탈질 환원 효소를 증가시키는 것을 확인했다. 따라서, 질산염은 N2O 발생량에 직접적인 영향을 미치는 인자로 파악할 수 있으며, NO3-는 탈질 반응 물질로서 NO3- 농도 증가는 탈질 반응 자체를 증가시키고 미생물 풍부도를 상승시킨다(Saleh-Lakha et al., 2009). 탈질 반응의 증가는 다단계 반응 중에 배출될 수 있는 탈질 중간 산물인 N2O 발생량을 증가시킬 수 있으며, 또한 충분한 NO3- 농도의 환경은 전자수용체로 N2O 기체를 N2로 환원하는 과정보다 NO3-를 환원하는 하는 것이 우호적으로 일어날 수 있다(Zhu et al., 2013). 따라서 NO3-는 N2O의 발생량을 직접적으로 증가시키며 이런 경향은 위 모델에서도 나타났다.
TP 증가에 따라 0.02 mg/L까지 N2O 발생량이 증가하다 0.03 mg/L에서 급격히 N2O 발생량이 감소한다. 일부 탈질 과정은 denitrifying phosphate accumulating organisms(DAPOs, 탈질화 인 축적 미생물)에 의해서 미생물의 생체 내로 인을 축적하는 과정과 같이 발생하며, 혐기적 조건에서 외부의 탄소 기질을 polyhydroxyalkanoates (PHAs) 형태로 축적하여 PHAs를 탄소원으로 탈질 과정을 진행하는 방식으로 인을 흡수한다(Tsuneda et al., 2006; Wang et al., 2015). 따라서 미생물이 인을 생체 내로 축적하는 과정을 통해서 수중의 TP가 감소하는 경향을 나타낼 수 있으며 E1 실험의 높은 탈질 활동은 탈질 미생물의 활동으로 유추할 수 있고 미생물의 활동이 활발한 퇴적물에서 더 높은 수준의 인 축적이 발생하여 E1과 E2 실험의 총 인의 농도가 다르게 나타난다. E1 실험 수중의 인 농도는 0.01621 ± 0.004 mg/L, E2 실험에서 0.03394 ± 0.005 mg/L로 약 2배 차이를 나타나며 미생물의 풍부도와 관련한 영향이 있을 것으로 판단된다. 동일한 조건의 실험에서 활발한 미생물 활동은 인의 축적으로 수중의 TP를 감소시켜 실험간 농도차이를 나타내고 N2O와 음의 상관관계를 보인다. 이는 TP 농도가 약 0.03 mg/L에서 증가할수록 급격히 N2O 발생량이 감소하는 관계에서 실험간 농도차이에 의한 것으로 유추할 수 있다.
암모늄 증가는 10 μg-N/g dry soil에서 급격한 N2O 발생량 증가와 그 이후 증가폭은 감소하지만 낮은 수준으로 지속적으로 증가하는 경향을 보인다. 암모늄의 증가는 N2O 발생량을 증가시키는데, 이는 연결된 질산화-탈질(coupled nitrification- denitrification)에서 질산화 과정 산물을 증가시키거나 질산화 자체에서 Hodroxylamine 산화 과정의 부산물로 생성되는 N2O 발생을 증가시키고, 질산세균 탈질화 과정에서 N2O 발생량을 증가시킨다(Dong et al., 2018; Schreiber et al., 2012; Wang et al., 2017b; Wang et al., 2017a; Zumft and Kroneck, 2006). 이와 유사하게 암모늄은 RF 모델에서 N2O 발생량과 높은 수준의 양의 상관관계를 보일 뿐만 아니라, 지형적 특성에 따라 N2O 발생량과 유사한 농도 경향을 보였다(Fig. 2(c)). 높은 DOC 농도(E1)에서 나타난 지형적 차이는 혼합대 내부의 미세지형의 화학적 차이를 나타낸다. 혼합대 내의 공간적으로 불균등한 미세지형의 차이와 생지화학적인 요소의 차이를 보인다.
N2O 발생량의 위치 별 차이는 D 지점에서 가장 높게 나타났다. RF 모델은 무작위적인 모델들의 앙상블을 통해서 각 요소들의 다중공산성을 배제하는데 적합한 모델로 DOC 농도가 N2O 발생량의 지형적 변화를 야기한다는 상관관계를 최대한 배제한 상태에서 지형적 차이가 N2O 발생에 직접적으로 미칠 수 있는 영향을 모델링한 것이다. RF 모델의 결과 또한 지형적 차이에 의한 N2O 발생량의 경향이 E1 실험의 N2O 발생량과 유사한 결과를 보여준다(Figs. 2 and 4.). 정체시간이 짧은 지점인 A, B, C 지형은 기질이 유입되는 과정이 주요하게 작동하며 혼합대 내부로 물이 흐르기 때문에 미생물이 탈질을 수행하기에 반응시간이 길지 않으며, 물의 흐름 방향으로 산소 유입을 통해 산소 농도가 사구 뒤쪽 경사 지형보다 높을 수 있아 탈질이 연속적으로 일어나기 어렵다(Quick et al., 2016; Quick et al., 2019). 반응시간, 정체시간이 늘어나면서 D지점에서 N2O 발생량이 최대가 되며, E 지점은 완전 탈질이 발생하기 충분한 정체시간을 가지고 있어 다시 N2O 발생량이 줄어든다. 실험 가설과 같은 연속적인 다단계 반응인 탈질이 A~E 위치에 따라 순차적인 증가와 감소 모형을 나타내지 않은 것은 E2 실험에서 지형적 변화가 낮은 DOC 농도에 의해 억제되었던 결과 또한 모델의 데이터로 사용되었기 때문이라고 여겨진다. 그럼에도 모델은 지형적 변화만으로도 N2O 발생량의 변화가 나타난 것을 보여준다.
4. 결 론
본 연구에서 인공 수로에 사구 지형을 형성하여 미세지형 따라 변화하는 생지화학적 특성과 N2O 발생량 변화를 추정하고, N2O 발생량에 영향을 미치는 요인들을 RF 모델을 통해 설명하고 N2O 발생량 변화를 모델링하였다. N2O 발생량의 지형적 변화는 높은 DOC 농도에서 발생했으며 낮은 DOC 농도에서는 그 변화가 나타나지 않았다. 이런 차이는 DOC가 탈질의 기질로서 탈질 반응의 활동성을 조절하기 때문에 지형적 차이가 나타나는 것을 조절한다고 할 수 있다. 충분한 DOC 농도가 주어진 환경에서 N2O 발생량은 지형 변화에 따라 변화하였고 암모늄 농도와 같은 화학적 특성의 농도 차이를 만들어 혼합대 흐름에 따라 미세지형의 변화를 가져왔다. 하상 미지형에 따라 탈질 미생물 반응 정도에 영향을 주는, 질소 산화물과 유기물 기질의 정체시간 차이를 만들었다. 본 실험의 N2O 발생량 변화 경향은 하상 내부를 흐르는 물 흐름의 길이와 체류시간에 따라서 사구 형태의 지형 내에서 앞쪽 경사는 낮은 발생량을, 뒤쪽 경사는 높은 발생량을 보였다. 사구를 따라 변화하는 흐름길이와 탈질 반응 정도와 따라 탈질 중간 산물인 N2O의 발생량이 달라지는 경향은 D지점에서 가장 높은 값을 가짐에 따라, 다단계 연속반응인 탈질 과정 중에 발생하는 N2O의 양은 혼합대 흐름길이에 변화에 따라 N2O 발생량을 기준으로 최적 체류시간을 가질 것임을 확인하였다.
N2O 발생에 영향을 미치는 미세지형 환경요인을 확인하기 위해, RF 모델을 통하여 관련 되어있는 요소들이 N2O 발생량에 미치는 영향과 정도를 확인할 수 있었다. RF 모델 결과에 따르면 N2O 발생에 가장 주요한 영향을 미치는 요소는 토양 DOC 농도로, DOC 농도 증가에 따라 N2O 발생양이 계단식으로 증가하는 점직전인 관계를 보여주었다. 토양 DOC가 증가할수록 하상에서 N2O의 발생량이 증가하고, N2O 발생량이 미지형에 따라 달라진다는 것을 첫 번째 실험(E1)에서 확인하였고, 이런 미지형에 따른 효과는 토양 DOC가 적은 두 번째 실험(E2)에서는 발생하지 않고 오히려 앞쪽 경사인 유입부 쪽에서 많이 발생하는 것으로 보아, 기질이 제한된 조건에서는 먼저 물질에 접근이 가능한 앞쪽 경사에서 탈질이 활발하게 발생하는 것으로 보인다. 즉, 토양 DOC는 N2O 발생량 자체에 영향을 미칠 뿐만 아니라 미세지형의 효과를 조절하는 작용을 한다는 것으로 확인했다.
본 실험은 하상의 물리적 변화와 기질의 이용성 차이에 따라 N2O 발생량이 변화가 나타나는 것을 확인하였다. 사구 실험에서 지형적 차이로 형성된 미세지형의 차이가 N2O 발생량 변화 나타났으며, 이는 DOC 농도, 탄소 기질이용성에 의해서 제한된다. 향후 하상형태의 복잡한 형태의 정의와 수리조건, 하상 토양의 입도와 성질에 따른 더 복잡한 상호관계에 대한 확인이 필요하다고 여겨진다. 그럼에도 불구하고 해당 실험은 하상 미세지형의 변화에 따른 N2O 발생량 변화 그리고, 그것에 미치는 DOC의 영향을 보여주면서 하상형태 특성과 기질이용성의 상호작용이 N2O 발생량에 미치는 영향과 같은 상관관계를 규명했다. 본 연구를 통해서 하상의 탈질 과정 중 발생하는 N2O 발생량을 예측하기 위한 중요인자들을 확인하였으며, RF 모델을 사용해 N2O 발생량 모델을 형성하였다. 이와 같은 통해서 미래 환경변화나 생태계 특성 변화에 따른 N2O 발생량 변화를 예측하는 것에 활용할 수 있을 것이라 판단된다.